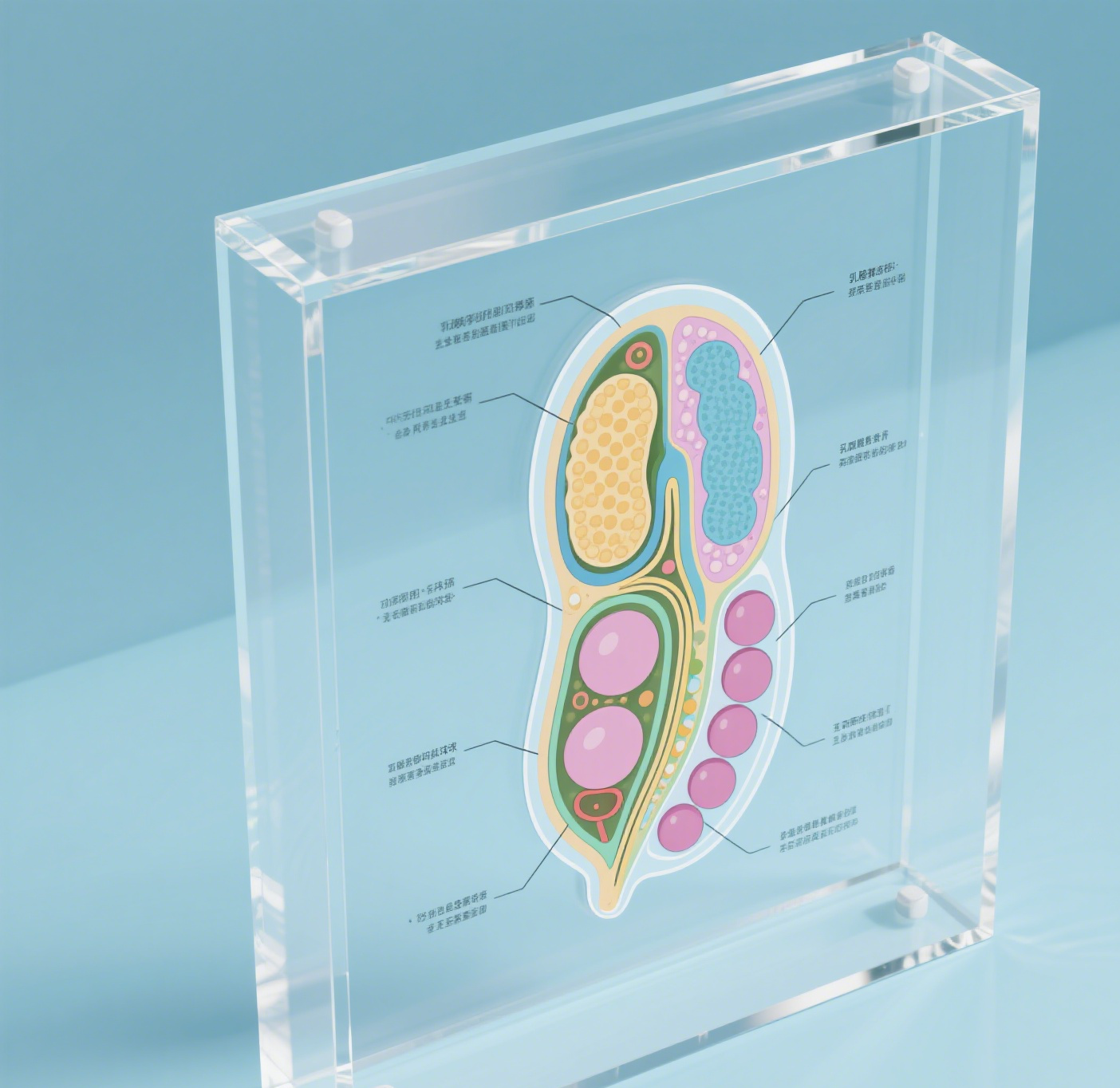
structure du nisin
La structure de la nisin représente un peptide antimicrobien révolutionnaire composé de 34 résidus d'acides aminés, produit naturellement par certaines souches de Lactococcus lactis. Ce composé remarquable présente une architecture moléculaire unique caractérisée par cinq anneaux interconnectés, formés grâce à des ponts en thioéther spécifiques et à des acides aminés inhabituels. La structure contient des anneaux de lanthionine distinctifs qui sont essentiels pour son activité antimicrobienne. Ces anneaux permettent à la nisin de se lier efficacement aux parois cellulaires bactériennes, créant des pores qui conduisent finalement à la mort cellulaire. La nature amphiphile du peptide, combinant des régions hydrophiles et hydrophobes, lui permet de fonctionner efficacement dans divers environnements. Son poids moléculaire d'environ 3 354 daltons le rend particulièrement efficace contre les bactéries à Gram positif, tandis que sa stabilité dans des conditions acides renforce ses applications pratiques. La flexibilité remarquable de la structure lui permet de maintenir ses propriétés antimicrobiennes sur différentes plages de température et de pH, ce qui la rend inestimable dans la conservation des aliments et les applications pharmaceutiques. De plus, la structure de la nisin montre une excellente biodégradabilité et n'est pas toxique pour les humains, ce qui en fait une option écologique et sûre pour diverses applications industrielles.