nisin structuur
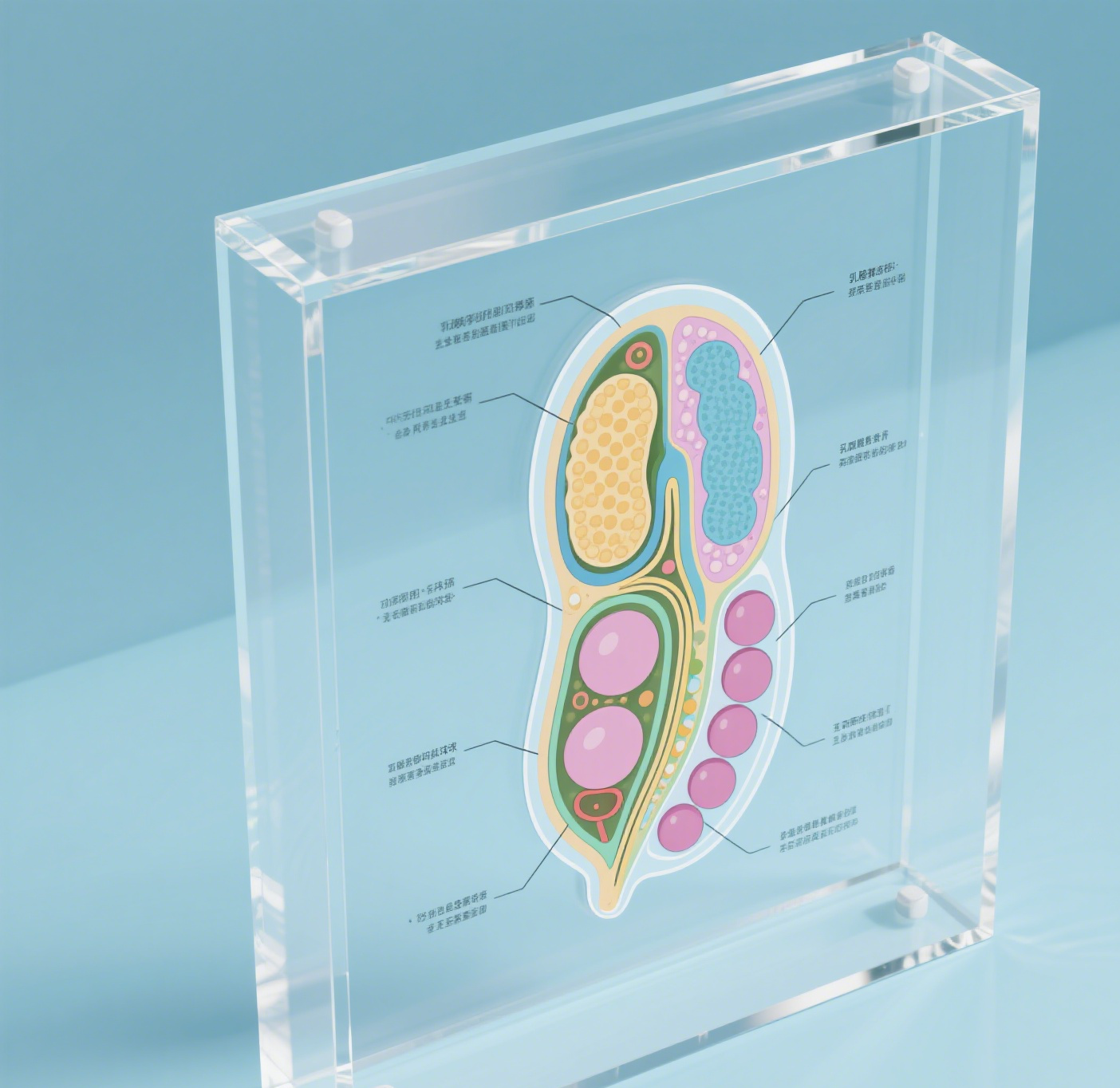
De structuur van nisin vertegenwoordigt een doorbraak in antimicrobiële peptiden, samengesteld uit 34 aminozuren, natuurlijk geproduceerd door bepaalde stammen van Lactococcus lactis. Dit opmerkelijke compound heeft een unieke moleculaire architectuur gekenmerkt door vijf in elkaar verstrengelde ringen, gevormd door specifieke thioetherbruggen en ongebruikelijke aminozuren. De structuur bevat karakteristieke lanthionineringen die essentieel zijn voor zijn antimicrobiële activiteit. Deze ringen laten nisin effectief binden aan bacteriële celwanden, waardoor poriën ontstaan die uiteindelijk leiden tot celsterfte. Het amfifiele karakter van het peptid, dat zowel hydrofiel als hydrofoob is, laat het effectief functioneren in verschillende omgevingen. Zijn moleculaire gewicht van ongeveer 3.354 daltons maakt het bijzonder effectief tegen gram-positieve bacteriën, terwijl zijn stabiliteit in zuur milieu zijn praktische toepassingen versterkt. De opmerkelijke flexibiliteit van de structuur laat het zijn antimicrobiële eigenschappen behouden over verschillende temperatuur intervallen en pH-niveaus, wat het waardevol maakt in voedselconservering en farmaceutische toepassingen. Bovendien toont de structuur van nisin uitstekende biodegradabiliteit en mist toxiciteit voor mensen, wat het een milieuvriendelijke en veilige optie maakt voor verschillende industriële toepassingen.