nisin struktur
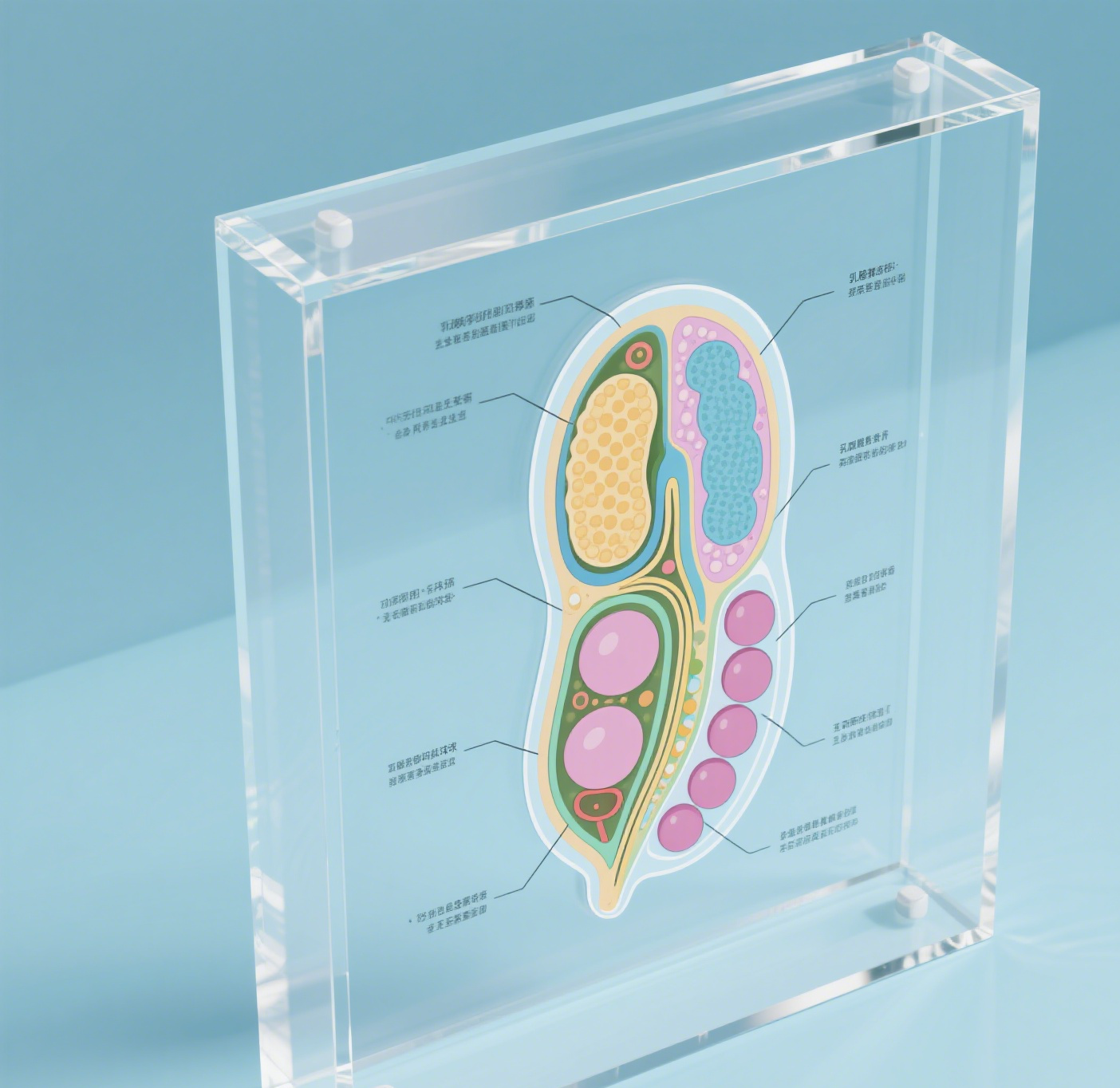
Nisin-strukturen repræsenterer en gennembrudspræget antimikrobiel peptid, der består af 34 aminosyrerests og produceres naturligt af visse stamme af Lactococcus lactis. Dette bemærkelsesværdige forbindelse har en unik molekylær arkitektur, der karakteriseres ved fem sammenlåste ringer, dannet gennem specifikke thioether-forbindelser og usædvanlige aminosyrer. Strukturen indeholder karakteristiske lanthionin-ringer, der er nødvendige for dets antimikrobielle aktivitet. Disse ringer giver nisin mulighed for effektivt at binde til bakterielle cellevejre og oprette pore, hvilket til sidst fører til celleafdøden. Peptidets amphiphile natur, som kombinerer både hydrofille og hydrofobe områder, gør det i stand til at fungere effektivt i forskellige miljøer. Dets molekylvægt på cirka 3.354 dalton gør det særlig effektivt mod gram-positive bakterier, mens dets stabilitet under surt forhold forbedrer dets praktiske anvendelighed. Strukturens bemærkelsesværdige fleksibilitet gør det i stand til at bevare sine antimikrobielle egenskaber over flere temperaturintervaller og pH-niveauer, hvilket gør det uerstatteligt inden for fødevarebevaring og farmaceutiske anvendelser. Desuden demonstrerer nisin-strukturen fremragende biodegradabilitet og mangler toksicitet overfor mennesker, hvilket gør det til et miljøvenligt og sikkert valg til forskellige industrielle anvendelser.